Mé cạnh sắt kẽm kim loại thì sắt kẽm kim loại kiềm thổ cũng chính là phần kỹ năng và kiến thức cần thiết nhưng mà những em học viên cần thiết ghi lưu giữ. Cùng bám theo dõi nội dung bài viết nhằm nắm rõ rộng lớn về cấu trúc, những đặc điểm, phần mềm của sắt kẽm kim loại kiềm thổ nhé!
1. Kim loại kiềm thổ - kỹ năng và kiến thức chung
1.1 Định nghĩa
- Các yếu tố chất hóa học nằm trong group IIA (Be 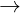 Ra) trong bảng tuần trả chất hóa học nằm trong nhóm Kim loại kiềm thổ . Nguyên tố Ra là yếu tố phóng xạ và chu kỳ luân hồi phân phối chảy cộc nên thông thường ko được kiểm tra cho tới.
Ra) trong bảng tuần trả chất hóa học nằm trong nhóm Kim loại kiềm thổ . Nguyên tố Ra là yếu tố phóng xạ và chu kỳ luân hồi phân phối chảy cộc nên thông thường ko được kiểm tra cho tới.
Bạn đang xem: Lý thuyết và bài tập về kim loại kiềm thổ
- Lý tự được gọi là là sắt kẽm kim loại kiềm thổ bởi những yếu tố này mang tính chất hóa học trung gian trá thân thích oxit của sắt kẽm kim loại khu đất khan hiếm và oxit sắt kẽm kim loại kiềm.
- Kim loại kiềm thổ sinh hoạt mạnh và khan hiếm Khi thám thính thây ở dạn đơn hóa học nhập bất ngờ, rung rinh 4,16% những hóa học nhập vỏ Trái Đất nhập đó:
+ Canxi: 67%
+ Magie: 31%
+ Bari: 1,4%
+ Stronti: 0,6%
+ Beri và Radi: Lượng nhỏ ko đáng chú ý.

1.2 Cấu tạo nên và vị trí
a. Vị trí: Kim loại kiềm thổ trong bảng tuần trả chất hóa học nằm trong group IIA
b. Cấu tạo:
| Nguyên tố |
Be |
Mg |
Ca |
Sr |
Ba |
| Cấu hình electron |
[He] 2s2 |
[Ne] 3s2 |
[Ar] 4s2 |
[Kr] 5s2 |
[Xe] 6s2 |
| Bán kính vẹn toàn tử (nm) |
0,089 |
0,136 |
0,174 |
0,191 |
0,220 |
| Độ âm điện |
1,57 |
1,31 |
1,00 |
0,95 |
0,89 |
>> Mời chúng ta tham lam khảo: Tổng ăn ý kỹ năng và kiến thức chất hóa học 12 chi tiết
2. Kim loại kiềm thổ - Tính chất
2.1 Tính hóa học vật lý
- Kim loại kiềm thổ đem sắc tố xám bạc hoặc white bạc, hoàn toàn có thể dát mỏng manh được tự phỏng cứng thấp và hạn chế dần dần theo hướng kể từ Be 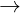 Ba. Kim loại kiềm thổ dẫn năng lượng điện đảm bảo chất lượng, dẫn sức nóng cũng khá đảm bảo chất lượng.
Ba. Kim loại kiềm thổ dẫn năng lượng điện đảm bảo chất lượng, dẫn sức nóng cũng khá đảm bảo chất lượng.

- Nhiệt phỏng sôi của sắt kẽm kim loại kiềm thổ > sắt kẽm kim loại kiềm.
| Nguyên tố |
Be |
Mg |
Ca |
Sr |
Ba |
| Nhiệt nhiệt độ chảy (oC) |
1280 |
650 |
838 |
768 |
714 |
| Nhiệt phỏng sôi (oC) |
2770 |
1110 |
1440 |
1380 |
1640 |
| Khối lượng riêng biệt (g/cm3) |
1,85 |
1,74 |
1,55 |
2,6 |
3,5 |
| Mạng tinh anh thể |
Lục phương |
Lục phương |
Lập phương tâm diện |
Lập phương tâm diện |
Lập phương tâm khối |
Tham khảo ngay lập tức cỗ tư liệu tổ hợp kỹ năng và kiến thức và những dạng bài xích tập luyện nhập đề thi đua Hóa trung học phổ thông Quốc Gia

2.2 Tính hóa học hóa học
Kim loại kiềm thổ đem tính khử mạnh tăng dần dần kể từ Be cho tới Ba, vì thế vậy tính hóa chất đặc thù của group này là dễ dàng nhượng bộ electron:
M 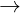 M2+ + 2e
M2+ + 2e
a. Tác dụng với nước
- Ba, Ca, Sr tính năng với H2O ở sức nóng phỏng thông thường tạo nên trở nên hỗn hợp Bazơ
Ca + 2H2O 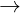 Ca(OH)2 + H2
Ca(OH)2 + H2
- Magie chỉ tan nội địa nóng
Mg + H2O 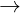 MgO + H2
MgO + H2
- Be đem lớp oxit đảm bảo an toàn bên phía ngoài nên ko tan nội địa. Tuy nhiên, Be hoàn toàn có thể tan nhập hỗn hợp kiềm giá chảy hoặc kiềm mạnh sẽ tạo trở nên berilat.
b. Tác dụng với axit
- Kim loại kiềm thổ tác dụng với axit H2SO4 loãng hoặc HCl thì ion H+ trong axit tiếp tục khử thành H2
Mg +2H+ 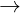 Mg2+ + H2
Mg2+ + H2
- Kim loại kiềm thổ Khi tính năng với axit HNO3, H2SO4 đặc tiếp tục khử N+5, S+6 thành ăn ý hóa học đem số lão hóa thấp rộng lớn.
4Mg + 5H2SO4 đặc 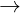 4MgSO4 + H2S + 4H2O
4MgSO4 + H2S + 4H2O
4Ca + 10HNO3 loãng 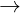 4Ca(NO3)2 + NH4NO3 + 3H2O
4Ca(NO3)2 + NH4NO3 + 3H2O
c. Tác dụng với phi kim
- Đốt sắt kẽm kim loại kiềm thổ nhập bầu không khí đưa đến oxit:
2Mg + O2 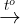 2MgO
2MgO
- Kim loại kiềm thổ phản xạ mạnh mẽ với lưu huỳnh, nitơ, phốt pho, halogen... ở sức nóng phỏng cao.
Ca + Cl2 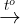 CaCl2
CaCl2
Mg + Si 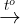 Mg2Si
Mg2Si
- Khi đung giá, sắt kẽm kim loại kiềm thổ hoàn toàn có thể khử được oxit bền:
2Be + TiO2 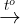 2BeO + Ti
2BeO + Ti
2Mg + CO2 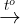 2MgO + C
2MgO + C
PAS VUIHOC – GIẢI PHÁP ÔN LUYỆN CÁ NHÂN HÓA
Khóa học tập online ĐẦU TIÊN VÀ DUY NHẤT:
⭐ Xây dựng suốt thời gian học tập kể từ mất mặt gốc cho tới 27+
⭐ Chọn thầy cô, lớp, môn học tập bám theo sở thích
⭐ Tương tác thẳng hai phía nằm trong thầy cô
⭐ Học tới trường lại cho tới lúc nào hiểu bài xích thì thôi
⭐ Rèn tips tricks gom tăng cường thời hạn thực hiện đề
⭐ Tặng full cỗ tư liệu độc quyền nhập quy trình học tập tập
Đăng ký học tập demo free ngay!!
Xem thêm: viết một đoạn văn ngắn trong đó có sử dụng từ đồng âm và từ đa nghĩa

3. Điều chế sắt kẽm kim loại kiềm thổ
- Kim loại kiềm thổ chỉ tồn bên trên trong số ăn ý hóa học bên dưới dạng ion M2+. Điều chế sắt kẽm kim loại kiềm thổ bằng phương pháp năng lượng điện phân giá chảy muối hạt của chúng:
CaCl2 ![\large \xrightarrow[]{dpnc}](https://latex.codecogs.com/gif.latex?%5Clarge%20%5Cxrightarrow%5B%5D%7Bdpnc%7D) Ca + Cl2
Ca + Cl2
MgCl2 ![\large \xrightarrow[]{dpnc}](https://latex.codecogs.com/gif.latex?%5Clarge%20%5Cxrightarrow%5B%5D%7Bdpnc%7D) Mg + Cl2
Mg + Cl2
4. Ứng dụng của sắt kẽm kim loại kiềm thổ
Kim loại kiềm thổ có không ít phần mềm nhập cuộc sống, nhập đó:
- Be được thêm nữa sẽ tạo rời khỏi những kim loại tổng hợp bền lâu hơn, đem tính đàn hồi cao hơn nữa và không xẩy ra bào mòn kim loại
- Ca được phần mềm làm chất khử nhằm tách lưu hoàng, oxi thoát ra khỏi thép, thực hiện thô một số trong những ăn ý hóa học cơ học.
- Mg là sắt kẽm kim loại kiềm thổ được dùng rộng thoải mái nhập cuộc sống. Mg kết phù hợp với những hóa học không giống tạo nên trở nên kim loại tổng hợp chắc chắn dùng nhập sản xuất phương tiện đi lại giao thông vận tải hoặc tranh bị. hầu hết hóa học cơ học được tổ hợp kể từ Mg. Mg còn được phần mềm nhập phát triển máy hình ảnh, pháo sáng sủa...
- Ứng dụng thông dụng nhất của Ca là sử dụng nhập phát triển xi-măng.
- Sr và Ba: sản xuất pháo hoa
5. Kim loại kiềm thổ - một số trong những dạng bài xích tập
Bài 1: Đốt chảy trọn vẹn 7,2g sắt kẽm kim loại M hóa trị ko thay đổi nhập lếu láo ăn ý khí Cl2 và O2. Thu được 2,3g hóa học rắn sau phản xạ. Thể tích khí tiếp tục phản xạ là 5,6 lít ở ĐK xài chuẩn chỉnh. Tìm sắt kẽm kim loại M.
Lời giải:
Số mol khí nhập cuộc phản xạ là: 5,6 : 22,4 = 0,25 mol.
Theo đề bài xích tao đem sắt kẽm kim loại M phản xạ với lếu láo ăn ý khí Cl2 và O2 sinh rời khỏi hóa học rắn.
=> mO2 + mCl2 = 23 - 7,2 = 15,8
Gọi số mol của O2 và Cl2 lần lượt là x và nó, tao đem hệ phương trình:

=> x = 0,2 ; nó = 0,05.
Gọi hóa trị của M nhập ăn ý hóa học là a, vận dụng quyết định luật bảo toàn electrong tao có:
a.nM = 2.nCl2 + 4.nO2
=> a. (7,2 : M) = 0,2.2 + 0,05.4
=> M = 12a => M là Mg.
Bài 2: Hòa tan trọn vẹn 2,9g hít kim loại tổng hợp loại A và oxit của chính nó nhập H2O. Ta chiếm được 500ml hỗn hợp có một hóa học tan đem độ đậm đặc là 0,04M và 0,224 lít khí hidro ở ĐK xài chuẩn chỉnh. Tìm A?
Lời giải:
Ta đem sơ đồ vật phản ứng: ( A, A2On) + H2O 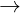 M(OH)n + H2
M(OH)n + H2
(0,01n +0,01) 0,02 0,01 (mol)
Áp dụng quyết định luật bảo toàn yếu tố => nH2O = (0,01n + 0,01) mol
Áp dụng quyết định luật bảo toàn lượng tao có:
2,9 + 18(0,01n + 0,01) = 0,02 ( A +17n) + 2.0,01
0,02A + 0,16n = 3,06 => A=137 ; n=2
=> Kim loại A là Ba.
Bài 3: Cho m gam Mg nhập hỗn hợp chứa chấp 0,12 mol FeCl3, tiếp sau đó chiếm được 3,36 g hóa học rắn (phản ứng hết). Tìm m?
Lời giài:
Ta đem phương trình:
Mg + 2Fe3+ 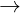 Mg2+ + 2Fe2+ (1)
Mg2+ + 2Fe2+ (1)
Mg + 2Fe2+ 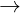 Mg2+ + Fe (2)
Mg2+ + Fe (2)
3,36 < 0,12.56 = 6,27
=> Dung dịch muối hạt còn dư sau phản xạ.
=> nFe sinh rời khỏi sau phản xạ = 3,36 : 56 = 0,06 mol
(2) nFe = nMg = 0,06 mol
(1) nMg = một nửa nFeCl3 = 0,06 mol
=> nMg = 0,06 + 0,06 = 0,12 mol
=> mMg = 0,12.24 = 2.88g
Đăng ký ngay để những thầy cô tư vấn và xây đắp suốt thời gian ôn thi đua trung học phổ thông Quốc Gia sớm và phù phù hợp với bạn dạng thân thích nhất nhé!

Trên đấy là toàn cỗ kỹ năng và kiến thức về kim loại kiềm thổ nhưng mà vuihoc share với chúng ta học viên. kỳ vọng rằng nội dung bài viết này sẽ hỗ trợ những em hoàn toàn có thể nắm rõ kỹ năng và kiến thức và giải được những dạng bài xích tập luyện hóa 12 đơn giản dễ dàng nhất. Đê học tập tăng nhiều kỹ năng và kiến thức hóa thú vị không giống, hãy truy vấn elcvietnam.edu.vn nhé!
Xem thêm: Toán lớp 5 trang 79, 80 Luyện tập chung | SGK Toán lớp 5
>> Mời chúng ta xem thêm thêm:
Lý thuyết về sắt kẽm kim loại kiềm
Nhôm và ăn ý hóa học của nhôm




